

山东罗欣药业集团股份有限公司招标公告
2024年5月18-21日,美国消化疾病周(DDW)在美国华盛顿举行。罗欣药业集团股份有限公司(简称“罗欣药业”)旗下消化领域创新药替戈拉生片幽门螺杆菌(Helicobacter pylori,Hp)III期临床研究入选2024年DDW口头报告1。

图注:替戈拉生片Hp III期临床研究入选DDW(官网页面)
DDW是世界上最大和最负盛名的GI专业会议。DDW是美国肝病研究学会(AASLD)、美国胃肠病学会(AGA)、美国胃肠内窥镜学会(ASGE)和消化道外科学会(SSAT)4个协会联合主办,是国际消化系统疾病领域规模最大、学术水平最高的会议及展览会,每年吸引约15000名来自世界各地该领域杰出的医师、研究员和学者。世界顶级专家将就胃肠病学、肝病学、内镜学和胃肠外科等领域的最新进展进行深入探讨。
流行病学研究表明,世界范围内一半以上人口感染幽门螺杆菌,我国幽门螺杆菌感染率为40%~60%2。幽门螺杆菌感染与多种疾病的发生有关,包括消化性溃疡、胃癌、慢性胃炎、黏膜相关淋巴组织淋巴瘤等3。此外,2021年12月,美国卫生及公共服务部下属美国毒理研究所公布了第15版致癌物报告,其中幽门螺杆菌慢性感染被列为明确人类致癌物4。国内外指南或共识一致推荐,证实有幽门螺杆菌感染者应进行根除治疗5-8。
此次入选研究是替戈拉生片在国内开展的一项多中心、随机、双盲双模拟的III期临床研究,由北京大学第三医院周丽雅教授牵头,旨在评价含替戈拉生对比含艾司奥美拉唑的铋剂四联疗法根除幽门螺杆菌的疗效和安全性。
该研究共纳入561例受试者,其中555例被纳入全分析集(Full Analysis Set,FAS)。受试者被随机分配至替戈拉生(50 mg)组或艾司奥美拉唑(20 mg)组治疗14天。主要终点是治疗后通过13C-尿素呼气试验确定幽门螺杆菌根除率,次要终点是在阿莫西林或克拉霉素不同敏感人群中的幽门螺杆菌根除率。
FAS中替戈拉生组和艾司奥美拉唑组的幽门螺杆菌根除率分别为93.5%(257/275)和86.4%(242/280)(差值7%;95%CI,2.06-11.99%)。证明了含替戈拉生铋剂四联疗法根除幽门螺杆菌的非劣效性。根据研究方案进行预先设定的优效性检验,结果表明含替戈拉生铋剂四联疗法优于含艾司奥美拉唑铋剂四联疗法(P=0.0055)。在阿莫西林或克拉霉素不同敏感人群中,替戈拉生组的Hp根除率均高于艾司奥美拉唑组,但差异无统计学意义(P>0.05)。在PPS(Per Protocol Set)中也观察到类似的结果。
两组之间的安全性相似。替戈拉生组和艾司奥美拉唑组的治疗中出现的不良事件发生率(treatment-emergent adverse event,TEAE)分别为75.5%(210/278)和73.4%(207/282),分别有173(62.2%)例和165(58.5%)例受试者报告了与研究药物有关的不良事件(treatment-related adverse event,TRAE)。最常见的不良事件是味觉倒错和血胃泌素升高/高胃泌素血症。2例(0.7%)替戈拉生组患者和1例(0.4%)艾司奥美拉唑组患者发生严重不良事件(serious adverse event,SAE),研究者判定与研究药物无关。
研究结果表明,含替戈拉生的铋剂四联疗法治疗中国感染幽门螺杆菌患者的疗效优于含艾司奥美拉唑的铋剂四联疗法,且在不同敏感耐药人群中均具有良好疗效,同时安全性和耐受性良好。
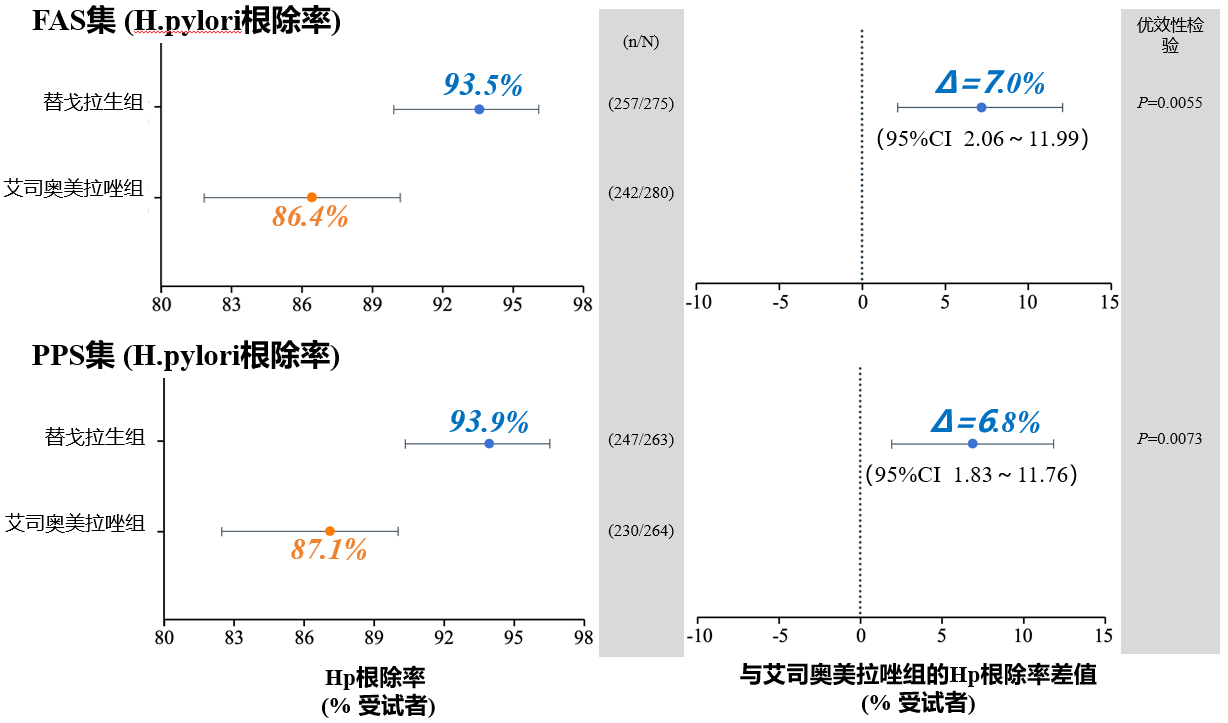
图注:替戈拉生组的幽门螺杆菌根除率优效于艾司奥美拉唑组
基于该研究,替戈拉生片已向国家药品监督管理局提交新适应症上市申请并获得受理,这是替戈拉生片申报的第3项适应症,另外两项已获批的适应症分别是反流性食管炎和十二指肠溃疡。替戈拉生片是我国首款自研钾离子竞争性酸阻滞剂类药物(Potassium-Competitive Acid Blockers,P-CAB),拥有全新抑酸作用机制。和传统抑酸药物相比,替戈拉生片拥有30分钟快速起效、黏膜愈合率高、有效改善夜间酸突破、药物相互作用较少,且服药方便不受进食影响等显著优势9-13,被认定为国家“重大新药创制”科技重大专项、山东省重大科技创新工程项目。替戈拉生片治疗反流性食管炎已通过医保谈判纳入2022版国家医保目录。此外,替戈拉生注射剂新药临床研究申请(IND)已获得国家药品监督管理局受理,目前全球范围内尚无同类注射剂产品上市。
-End-
参考文献:
1. Liya Zhou, Zhiqiang Song. A MULTICENTER, RANDOMIZED, DOUBLE-BLIND, DOUBLE-DUMMY PHASE III CLINICAL STUDY EVALUATING THE EFFICACY AND SAFETY OF BISMUTH QUADRUPLE THERAPY CONTAINING TEGOPRAZAN COMPARED TO ESOMEPRAZOLE IN ERADICATING HELICOBACTER PYLORI IN CHINA. Presentation Number: 656
2. 国家消化系疾病临床医学研究中心(上海), 国家消化道早癌防治中心联盟(GECA), 中华医学会消化病学分会幽门螺杆菌学组,等. 中国幽门螺杆菌根除与胃癌防控的专家共识意见(2019年,上海)[J]. 中华消化杂志, 2019, 39(005):310-316.
3. Malfertheiner P, et al. Gut 2017; 66:6-30.
4. 15th Report on Carcinogens.National Toxicology Program.December 21, 2021. https://ntp.niehs.nih.gov/go/roc15
5.中华消化杂志, 2017,37(06):364-378.
6.William D Chey,et al.Am J Gastroenterol. 2017 Feb;112(2):212-239.
7.Mototsugu Kato, et al. Helicobacter. 2019 Aug;24(4):e12597.
8.NICE Pathway:Helicobacter pylori testing and eradication in adults.2021.
9. He J, et al. Clin Drug Investig. 2021;41(1):89-97.
10. Lee KJ, et al. Aliment Pharmacol Ther. 2019 Apr;49(7):864-872.
11. Kim JS, et al. J Neurogastroenterol Motil. 2023 Jan 30;29(1):58-64.
12. Hwang S, et al. Front Pharmacol. 2021 Nov 11;12:754849.
13. Han S, et al. Clin Ther. 2021;S0149-2918(21)00237-X.