

山东罗欣药业集团股份有限公司招标公告
【规 格】(1)20mg (2)40mg(按C19H18N2O4S计)
【包 装】中硼硅玻璃管制注射剂瓶,冷冻干燥注射用无菌粉末用溴化丁基橡胶塞。
包装规格:1瓶/盒、2瓶/盒、5瓶/盒、10瓶/盒。
【单 位】瓶
【批准文号】(1)20mg:国药准字H20193380 (2)40mg:国药准字H20193381
注射用帕瑞昔布钠说明书
请仔细阅读说明书并在医师指导下使用。
【药品名称】通用名称:注射用帕瑞昔布钠
英文名称:Parecoxib Sodium for Injection
汉语拼音:Zhusheyong Paruixibuna
【成 份】本品主要成份为帕瑞昔布钠
化学名称:N-[[4-(5-甲基-3-苯基-4-异恶唑基)苯基]磺酰基]丙酰胺钠盐
化学结构式:
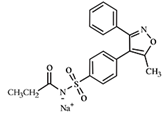
分子式:C19H17N2O4SNa
分子量:392.41
辅 料:无水磷酸氢二钠,磷酸(用于调节pH值)
【性 状】本品为白色或类白色冻干块状物或粉末。
【适 应 症】用于手术后疼痛的短期治疗。在决定使用选择性环氧化酶-2(COX-2)抑制剂前,应评估患者的整体风险。
【规 格】(1)20mg (2)40mg(按C19H18N2O4S计)
【用法用量】推荐剂量为40mg静脉注射(IV)或肌内注射(IM)给药,随后视需要间隔6~12小时给予20mg或40mg,每天总剂量不超80mg。由于选择性COX-2抑制剂的心血管事件发生风险随着剂量及暴露时间增加而增加,因此,应尽可能使用最短疗程及最低每日有效剂量。使用本品超过三天的临床经验有限。可直接进行快速静脉推注,或通过已有静脉通路给药。肌内注射应选择深部肌肉缓慢推注。由于本品与其它药物在溶液中混合可出现沉淀,因此不论在溶解或是注射过程中,本品严禁与其它药物混合。如帕瑞昔布与其它药物使用同一条静脉通路,帕瑞昔布溶液注射前后须采用相容溶液充分冲洗静脉通路。
与阿片类镇痛药联合用药:阿片类镇痛药可以与帕瑞昔布同时应用,本品使用剂量参见上文。在所有的临床评估中,帕瑞昔布是固定间隔时间给药,而阿片类药物则是按需给药。
老年患者:通常,对于老年患者(≥65岁)不必进行剂量调整。但是,对于体重低于50kg的老年患者,本品的初始剂量应减至常规推荐剂量的一半且每日最高剂量应减至40mg。
肝功能损伤:目前尚无严重肝功能损伤患者(Child-Pugh 评分:≥10)的临床用药经验,因此禁止在此类患者中使用帕瑞昔布。通常,轻度肝功能损伤的患者(Child-Pugh 评分:5~6)不必进行剂量调整。中度肝功能损伤的患者(Child-Pugh 评分:7~9)应慎用本品,剂量应减至常规推荐剂量的一半且每日最高剂量降至40mg。
肾功能损伤:对于重度肾功能损伤(肌酐清除率:<30ml/min)或有液体潴留倾向的患者,应选择最低推荐剂量
开始治疗并密切监测肾功能。依据帕瑞昔布的药代动力学,不必对轻度至中度肾功能损伤(肌酐清除率:
80ml/min)的患者进行剂量调整。
儿童用药:尚未确定18岁以下儿童使用帕瑞昔布的安全和疗效。目前尚无可用数据。因此,不推荐在此类人群中使用帕瑞昔布。
使用与处置(包括丢弃)指导说明 注射用帕瑞昔布钠使用前必须重新配制。由于不含防腐剂。因此要求采用无菌技术进行配制。
配制溶剂:可用于配制注射用帕瑞昔布钠的溶剂包括:氯化钠溶液9mg/ml(0.9%);葡萄糖注射液50mg/ml(5%);氯化钠4.5mg/ml(0.45%)葡萄糖50mg/ml(5%)注射液。
配制过程 采用无菌技术配制帕瑞昔布冻干粉(即帕瑞昔布)。去除启扣盖,暴露帕瑞昔布玻璃瓶橡胶瓶塞的中央部分。用无菌注射器及针头吸取适用溶剂(20mg帕瑞昔布钠用1ml溶剂配制,40mg帕瑞昔布钠用2ml溶剂配制),然后将针头插进橡胶瓶塞中央向瓶内注入溶剂。轻轻旋转瓶体使粉末完全溶解并在使用前仔细检查配制成的溶液。将瓶内全部药液抽出供单次给药。配制后,药液应为透明溶液。帕瑞昔布钠溶液应在使用前进行目测,确定溶液是否有不溶性微粒或发生变色。若观察到溶液发生变色,出现絮状物或不溶性微粒,则不得使用。配置后,帕瑞昔布钠溶液应在24小时内使用,否则应废弃。已经证实在25℃条件下,配制后药液(不得冷藏或冷冻)的物理、化学稳定性最长可保持24小时。因此,24小时应被视为药物配制后的最长有效期。然而,由于注射产品有微生物感染的重要风险,因此配制的溶液应立即使用,除非溶液的配制是在严格控制的、并经过验证的无菌环境中进行。除非满足上述条件,否则使用者必须在使用前控制其贮藏时间与条件。一般来说,在25℃条件下保存不应超过12小时。配制后的帕瑞昔布钠溶液为等渗溶液。
静脉通路溶液的相容性 采用适用溶液配制后,帕瑞昔布钠溶液只能以静脉注射、肌肉注射、或加入下列液体的静脉通路给药:氯化钠注射液9mg/ml(0.9%) 葡萄糖注射液50mg/ml(5%) 氯化钠4.5mg/ml(0.45%)和葡萄糖 注射液 乳酸林格氏液 由于可以导致帕瑞昔布在溶液中沉淀,故不推荐向含50mg/ml(5%)葡萄糖的乳酸林格氏液或其它未列出溶液的静脉通路中加入帕瑞昔布。配制后的药液仅供单次使用。任何配制后未使用的医药产品或废弃物品都应当按照当地要求予以处理。
药物的不相容性 除[使用与处置(包括丢弃)指导说明]所列药物外,帕瑞昔布不得与其它任何药物混合。本品不应与阿片类药物混和于同一注射器内给药。使用乳酸林格氏液或含50mg/ml(5%)葡萄糖的乳酸林格氏液配制,帕瑞昔布会在溶液中发生沉淀,故不推荐使用。不推荐使用注射用水,因为得到的溶液不等渗。帕瑞昔布钠溶液不应注入任何其它药物的静脉通路。帕瑞昔布钠溶液注射前后应用相容溶液充分冲洗静脉通路。由于可以导致帕瑞昔布在溶液中沉淀,故不推荐向含50mg/ml(5%)葡萄糖的乳酸林格氏液或其他[使用与处置(包括丢弃)的指导]中未列出溶液的静脉通路中加入帕瑞昔布。
【不良反应】安全特性总结 根据国外文献报道,本品最常见不良反应为恶心。发生最严重不良反应的情况少见或罕见,包括心肌梗死和严重低血压等心血管事件,以及过敏反应、血管性水肿和严重皮肤反应等超敏事件。冠状动脉搭桥术后使用本品治疗的患者,发生此类不良反应的风险较高,如心血管/栓塞事件(包括心肌梗死、卒中/短暂性脑缺血发作(TIA)、肺栓塞以及深静脉栓塞)、术后深部组织感染以及胸骨伤口愈合并发症。
不良反应列表在28项安慰剂对照临床研究中,5402名接受帕瑞昔布治疗的患者中,曾报告出现以下不良反应。由于无法根据现有数据估计发生率,因此将上市后经验中报告的不良反应列为“发生率未知”。在每个发生率类别中,不良反应均按MedDRA术语列出并按其严重程度降序排列。
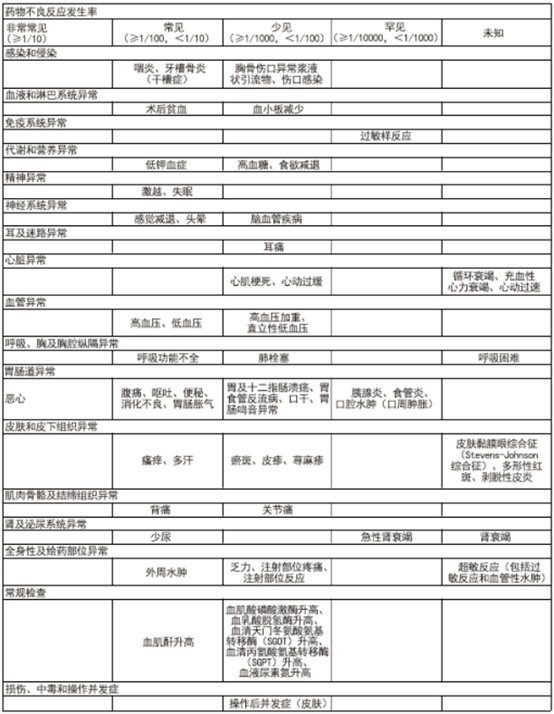
部分不良反应说明 依据上市后经验,曾有使用伐地昔布发生中毒性表皮坏死松解症的报告,不能排除使用帕瑞昔布发生该不良反应的可能。此外,以下罕见严重不良反应与使用非甾体抗炎药(NSAIDs)有关,并且不能排除使用帕瑞昔布发生这些不良反应的可能:支气管痉挛和肝炎。
报告可疑的不良反应 在药品获得上市批准后报告可疑不良反应非常重要,以便持续监测药品效益与风险之间的平衡。医务人员应报告任何可疑的不良反应。
【禁 忌】对注射用帕瑞昔布钠活性成份或辅料中任何成份有过敏史的患者。有严重药物过敏反应史,尤其是皮肤反应,如Stevens-Johnson综合征、中毒性表皮坏死松解症,多形性红斑等,或已知对磺胺类药物超敏者。有应用非甾体抗炎药后发生胃肠道出血或穿孔病史的患者。有活动性消化道溃疡或胃肠道出血的患者。服用阿司匹林或NSAIDs(包括COX-2抑制剂)后出现支气管痉挛、急性鼻炎、鼻息肉、血管神经性水肿、荨麻疹以及其他过敏反应的患者。处于妊娠晚期或正在哺乳的患者。严重肝功能损伤(血清白蛋白<25g/l或Child-Pugh评分≥10)患者。炎症性肠病患者。充血性心力衰竭(NYHAII-IV)患者。禁用于冠状动脉搭桥手术(CABG)术后疼痛的治疗。已确定的缺血性心脏疾病,外周动脉血管和/或脑血管疾病的患者。
【注意事项】本品已在口腔科、骨科、妇科(主要是子宫切除手术)以及冠状动脉搭桥术中进行了研究。但在其它类型手术中的研究有限,如胃肠道或泌尿道手术(参见[临床试验])。由于静脉注射(IV)和肌内注射(IM)给药以外的其他给药方式(如关节内给药、硬膜内给药)的研究缺乏,因此不应使用其他给药方式。
由于较高剂量的帕瑞昔布、其它COX-2抑制剂以及NSAIDs可能增加不良反应发生率,对接受帕瑞昔布治疗的患者在剂量增加后应进行评估,在剂量增加而疗效并未随之改善时,应考虑其它治疗选择。应用本品超过三天的临床经验有限(参见[临床试验])。如果在治疗过程中,患者发生下述任何器官的功能减退,应采取适当措施并考虑停用帕瑞昔布治疗。由于单位剂量本品的钠含量低于1mmol(23mg),因此基本上可视为“无钠”。根据控制症状的需要,在最短治疗时间内使用最低有效剂量,可以使不良反应降到最低。
心血管 长期使用选择性COX-2抑制剂可增加心血管系统及血栓相关不良事件的风险。尚未确定单剂量治疗的风险程度以及导致风险增加的具体治疗周期。针对多种COX-2选择性或非选择性NSAIDs药物持续时间达3年的临床试验显示,此类药物可能引起严重心血管血栓性不良事件、心肌梗死和卒中的风险增加,其风险可能是致命的。所有的NSAIDs,包括COX-2选择性或非选择性药物,可能有相似的风险。有心血管疾病或心血管疾病危险因素的患者,其风险更大。即使既往没有心血管症状,医生和患者也应对此类事件的发生保持警惕。应告知患者严重心血管安全性的症状和/或体征以及如果发生应采取的步骤。患者应该警惕诸如胸痛、气短、无力、言语含糊等症状和体征,而且当有任何上述症状或体征发生后应该马上寻求医生帮助。如果患者具有发生心血管事件的高危因素(如:高血压、高血脂、糖尿病、吸烟),采用本品治疗前应认真权衡利益风险。有高血压和/或心力衰竭(如液体潴留和水肿)病史的患者应慎用。如果患者在接受帕瑞昔布治疗期间,特定临床症状恶化,应进行适当检查,并考虑停止帕瑞昔布治疗。除冠状动脉搭桥术外,本品未在心血管血运重建术中进行过研究;其他手术的研究仅纳入了ASA(美国麻醉协会)分级Ⅰ-Ⅲ级的患者。
阿司匹林和其他NSAIDs 由于选择性COX-2抑制剂缺少抗血小板作用,它不能替代阿司匹林用于预防心血管血栓栓塞类疾病。因此,治疗期间不能中止抗血小板治疗。与华法林或其它口服抗凝血药同时使用时,应严密观察。应避免将本品与其他非阿司匹林的NSAIDs合用。本品可能掩盖发热和其他炎症症状。应用NSAIDs及本品的非临床研究中均有软组织感染加重的个案报道。术后患者接受本品治疗时应密切观察手术切口是否出现感染迹象。
胃肠道 帕瑞昔布治疗中曾有患者出现上消化道并发症[穿孔、溃疡以及出血(PUBs)],其中有些导致严重结果。服用NSAIDs的患者可能引发胃肠道并发症,应对以下患者进行密切关注:老年人,服用其它NSAIDs或阿司匹林、糖皮质激素、选择性5-羟色胺再摄取抑制剂的患者,饮酒的患者或有过胃肠道疾病病史(如溃疡或胃肠道出血)的患者。当帕瑞昔布钠与阿司匹林(包括低剂量)同时服用时,患者出现胃肠道不良事件的风险会进一步增加(胃肠道溃疡或其它胃肠道并发症)。在使用所有NSAIDs治疗过程中的任何时候,都可能出现胃肠道出血、溃疡和穿孔的不良反应,其风险可能是致命的。这些不良反应可能伴有或不伴有警示症状,也无论患者是否有胃肠道不良反应史或严重的胃肠事件病史。当患者服用该药发生胃肠道出血或溃疡时,应停药。老年患者使用NSAIDs出现不良反应的频率增加,尤其是胃肠道出血和穿孔,其风险可能是致命的。
皮肤反应 上市后临床监测显示,接受帕瑞昔布治疗的患者有发生严重皮肤反应的报道,包括多形性红斑,剥脱性皮炎,和Stevens-Johnson综合征,其中有些是致命的。此外,上市后临床监测显示,接受伐地昔布(帕瑞昔布的活性代谢产物)的患者有出现中毒性表皮坏死松解症的致死性报告,不能排除使用帕瑞昔布发生该不良反应的可能。患者在治疗早期出现上述不良事件的风险最高,大部分患者在治疗开始后第一个月出现上述反应。医生应采取适当措施监测治疗中的任何严重皮肤反应,如增加患者访视。应告知患者如果出现任何突发的皮肤状况,立即向医生报告。患者一旦出现皮疹,粘膜损伤,或其它超敏征兆,应停止帕瑞昔布治疗。和其它药物一样,包括选择性COX-2抑制剂在内的NSAIDs都可能引起严重皮肤反应。但与其它COX-2选择性抑制剂相比,伐地昔布严重皮肤不良事件的报告比率更高。有磺胺类药物过敏史的患者可能更易产生皮肤反应。但没有磺胺类药物过敏史的患者也可能产生严重皮肤反应。
超敏反应 根据上市后经验,使用伐地昔布或帕瑞昔布均可发生超敏反应(过敏反应和血管性水肿)。其中一些反应主要发生在有磺胺类药物过敏史的患者中。一旦出现过敏迹象,应停止帕瑞昔布治疗。在上市后的使用中有接受帕瑞昔布后短时间内发生严重低血压的病例。其中的一些病例是在没有过敏反应征兆的情况下发生的。医生应该做好治疗严重低血压的准备。
体液潴留、水肿、肾功能 和其他抑制前列腺素合成的药物一样,在使用帕瑞昔布的部分患者中曾观察到体液潴留及水肿的发生。因此,帕瑞昔布应慎用于在心功能不全、已存在水肿或其他有体液潴留倾向或由于体液潴留而加重病情的情况下,包括正在接受利尿剂治疗或其他存在低血容量风险的患者。如果这些患者临床情况恶化,应采取适当措施,包括停用帕瑞昔布。上市后临床监测称,有接受帕瑞昔布治疗的患者出现急性肾功能衰竭的报道。由于抑制前列腺素合成可能导致肾功能恶化以及体液潴留,因此本品用于肾功能损伤、高血压、心脏功能不全、肝功能损伤,以及其它具有体液潴留倾向的患者时,应予以密切观察。脱水的患者开始使用本品治疗时,应予以密切注意。建议先为此类患者补充足够的水分,再采用本品治疗。
高血压 和所有NSAIDs一样,帕瑞昔布可导致新发高血压或加重已有的高血压,其中的任何一种都可以导致心血管事件的发生率增加。服用噻嗪类或髓袢利尿剂的患者服用NSAIDs时,可能会影响这些药物的疗效。高血压患者应慎用帕瑞昔布。在开始使用帕瑞昔布治疗和整个治疗过程中应密切监测血压。如果血压明显升高,应考虑替代治疗。
肝功能损害 中度肝功能损伤(Child-Pugh评分:7~9)的患者接受本品治疗时应予以密切注意。若患者在接受本品治疗后出现头晕、眩晕或嗜睡等症状,则应停止驾驶车辆或操纵机器。
与口服抗凝血剂合用 NSAIDs与口服抗凝血剂合用会增加出血的风险。口服抗凝血剂包括华法林/香豆素类及新型口服抗凝血剂(例如阿哌沙班、达比加群和利伐沙班)。(参见[药物相互作用])。
【孕妇及哺乳期妇女用药】妊娠 妊娠晚期使用帕瑞昔布,怀疑有可能引起严重出生缺陷。与其它抑制前列腺素的药物一样,帕瑞昔布可导致胎儿动脉导管提前闭合或孕妇子宫收缩无力。妊娠中期或晚期使用NSAIDs可能引起胎儿肾功能不全,这可能会导致羊水量减少,严重时可导致羊水过少。此影响可能发生于治疗开始后不久,且通常可逆转。对使用NSAIDs的孕妇,应密切监测羊水量。本品禁用于妊娠晚期参见[禁忌])。与其它抑制COX-2的药物一样,不推荐有受孕计划的妇女使用帕瑞昔布。妊娠或分娩期妇女应用帕瑞昔布的研究数据不充足。然而,抑制前列腺素的合成可能对妊娠产生不良影响。流行病学研究显示,妊娠早期应用前列腺素合成酶抑制剂可能会增加自然流产的机会。在动物中应用前列腺素合成酶抑制剂(包括帕瑞昔布),会增加受精卵着床前后丢失以及胚胎-胎仔死亡的发生。除非必要,否则在妊娠早期和中期不应使用本品。给予雌性大鼠毒性作用剂量的研究和给予兔最大可评估剂量的研究均显示受精卵着床后丢失,未显示胚胎毒性。这与其他前列腺素合成酶抑制剂已有的研究一致。
哺乳 帕瑞昔布及其活性代谢物经哺乳期大鼠的乳汁分泌。给予剖腹产后哺乳期妇女单剂量帕瑞昔布,有相对少量帕瑞昔布及其活性代谢物(伐地昔布)经乳汁分泌,乳汁中相对低的剂量暴露给婴儿(约为母体体重-调整剂量的1%)。正在哺乳的妇女不得使用本品。由于帕瑞昔布对哺乳中婴儿的潜在风险,应根据药物对母亲的重要性而决定是否停止哺乳或停止药物应用。
生育 和其它已知的抑制环氧化酶/前列腺素合成的药物一样,对有受孕计划的妇女不推荐使用本品。根据NSAIDs的作用机制,应用NSAIDs可能会延迟或抑制排卵,由此在部分女性中会出现可逆性的不孕。对于受孕困难或查找不孕原因的女性,应考虑停用NSAIDs,包括帕瑞昔布。
【儿童用药】尚未确定18岁以下儿童使用帕瑞昔布的安全性和疗效。目前尚无可用数据。因此,不推荐在此类患者中使用帕瑞昔布。
【老年用药】老年患者(≥65岁)应用本品一般不需进行剂量调整。对于体重低于50kg的老年患者,初始剂量应减至常规推荐剂量的一半且每日最高剂量应减至40mg。
【药物相互作用】药效学相互作用 正在接受华法林或其它抗凝血药物治疗的患者使用本品,将增加发生出血并发症的风险,尤其在治疗开始后数天内。应密切监测同时服用抗凝血药物患者的凝血酶原时间国际标准化比(INR),特别是在开始使用帕瑞昔布或对帕瑞昔布进行剂量调整后数日内。本品对阿司匹林抑制血小板聚集的作用或出血时间没有影响。本品可以与低剂量(≤325mg)阿司匹林合用。临床研究提示,与其它NSAIDs一样,帕瑞昔布和低剂量阿司匹林合用将增加发生消化道溃疡或其它消化道并发症的风险。与单独使用肝素相比,帕瑞昔布与肝素合用不影响肝素的药效学特性(活化部分凝血活酶时间)。前列腺素受到NSAIDs(包括COX-2抑制剂)抑制可能会降低血管紧张素转化酶(ACE)抑制剂、血管紧张素II拮抗剂、β受体阻滞剂和利尿剂的作用。在同时使用帕瑞昔布与ACE抑制剂、血管紧张素II拮抗剂、β受体阻滞剂及利尿剂的患者中应考虑这种药物相互作用。老年人、容量不足者(包括利尿剂治疗者)或肾功能受损者,合用非甾体抗炎药(包括选择性COX-2抑制剂)与ACE抑制剂或血管紧张素II拮抗剂时可能导致肾脏功能进一步恶化,包括可能出现急性肾功能衰竭。这些影响通常是可逆的。因此,合用这些药物时应慎重。患者应补充足够的水分,联合用药开始时及此后应定期对监测肾功能的必要性进行评估。由于NSAID对肾脏前列腺素的作用,NSAIDs与环孢霉素或他克莫司合用可以增强环孢霉素或他克莫司的肾毒性。若帕瑞昔布与此类药物合用时,应监测肾功能。本品可以和阿片类止痛药合用。在临床研究中,当与帕瑞昔布联合用药时,可以显著减少按需给药的阿片类药物的每日需求量。
其他药物对帕瑞昔布(或其活性代谢物伐地昔布)药代动力学的作用 帕瑞昔布可快速水解为活性代谢物伐地昔布。临床研究证实,伐地昔布的代谢主要由细胞色素P450(CYP)3A4及2C9同工酶介导完成。与氟康唑(主要是CYP2C9抑制剂)合用时,伐地昔布的血浆暴露水平升高(AUC上升62%,Cmax上升19%)。正在接受氟康唑治疗的患者合并使用帕瑞昔布,应降低帕瑞昔布剂量。与酮康唑(主要是CYP3A4抑制剂)合用时,伐地昔布的血浆暴露水平升高(AUC上升38%,Cmax上升24%)。但接受酮康唑治疗的患者合用帕瑞昔布,无需调整帕瑞昔布剂量。尚未对酶的诱导作用进行研究。当与酶诱导剂(如利福平、苯妥英、卡马西平或地塞米松等)合用时,可加速伐地昔布的代谢过程。
帕瑞昔布(或其活性代谢产物伐地昔布)对其他药物药代动力学的作用 使用伐地昔布治疗(每次40mg,一日两次,共计7天)可导致右美沙芬(CYP2D6底物)血浆浓度升高3倍。当帕瑞昔布与主要经CYP2D6代谢并治疗剂量窗狭窄的药物(如氟卡尼、普罗帕酮及美托洛尔)合用时应密切监测。伐地昔布治疗(每次40mg,一日两次,共计7天)引起奥美拉唑(CYP2C19底物)(每次40mg,一日一次)血浆暴露水平升高46%,但伐地昔布的血浆暴露水平不受影响。上述结果提示,尽管伐地昔布不经CYP2C19酶代谢,但它仍可能是该酶的抑制剂。因此,当本品与已知的CYP2C19底物(例如:苯妥英、地西泮或丙咪嗪)合用时应予密切注意。在两项药代动力学药物相互作用研究中,每周甲氨蝶呤剂量稳定(5-20mg/周,单次口服或肌注)的类风湿性关节炎患者,口服伐地昔布(每次10mg,一日两次或每次40mg,一日两次)对稳态时甲氨蝶呤的血浆浓度影响较小或无影响。然而,由于使用NSAID可能会导致血浆甲氨蝶呤水平升高,因此当甲氨蝶呤与NSAIDs合用时应谨慎。当帕瑞昔布与甲氨蝶呤合用时,仍应对甲氨蝶呤相关的毒性反应进行充分监测。伐地昔布与锂剂合用可导致锂血清清除率及肾脏清除率明显下降(分别为25%,30%),同时,锂的血清暴露水平较单独使用锂剂时升高34%。正在接受锂剂治疗的患者,在开始帕瑞昔布治疗或者调整帕瑞昔布剂量时,应严密监测其血清中的锂浓度。当伐地昔布与格列本脲(CYP3A4底物)合用时,前者不影响格列本脲的药代动力学(暴露水平)及药效学(血糖及胰岛素水平)特性。
注射型麻醉剂:帕瑞昔布钠40mg与丙泊酚(CYP2C9底物)或咪达唑仑(CYP3A4底物)同时静注,帕瑞昔布不影响静注的丙泊酚或咪达唑仑的药代动力学(代谢与暴露水平)及药效学(脑电图、精神运动性测试以及对镇静状态的唤醒)特性。此外,当伐地昔布与咪达唑仑合并用药时,前者对口服咪达唑仑肝脏内以及小肠内由CYP3A4介导的代谢过程没有临床显著影响。静注帕瑞昔布钠40mg对静注芬太尼或阿芬太尼(CYP3A4底物)的药代动力学没有显著影响。
吸入型麻醉剂:尚未正式进行药物相互作用研究。帕瑞昔布钠于术前给药,在同时使用帕瑞昔布和吸入型麻醉剂(一氧化氮和异氟烷)的患者中没有发现两类药物在药效学方面有相互作用。
【药物过量】帕瑞昔布过量应用的不良事件报道与帕瑞昔布推荐剂量下所报道的不良事件存在相关性。一旦发生药物过量,应予对症处理以及支持治疗。血液透析无法从体内清除伐地昔布。由于伐地昔布的高血浆蛋白结合率,利尿与碱化尿液的方法也无助于药物排出。
【临床试验】帕瑞昔布已在多种大型和小型手术中使用。根据国外文献报道,本品的疗效已经在口腔科、妇科(子宫切除术)、骨科(膝关节与髋关节置换)术后以及冠状动脉搭桥术后的止痛治疗中得到确认。单次静注或肌注帕瑞昔布40mg后,7~13分钟时出现可感知的止痛作用,23~39分钟时产生具有临床意义的止痛作用,并于2小时内达到最大效果。帕瑞昔布40mg的止痛作用与肌注酮咯酸60mg或静注30mg的作用相仿。单次给药后,本品止痛时间的长短与给药剂量及疼痛模型有关,范围在6~12小时甚至更长。使用帕瑞昔布超过三天:大多数试验设计为帕瑞昔布给药不超过3天。有3项随机、安慰剂对照试验方案允许帕瑞昔布治疗时间超过3天,对这些数据进行了汇总和分析。676例患者的汇总分析中,318例接受安慰剂,358例接受帕瑞昔布治疗。在接受帕瑞昔布治疗的患者中,317例治疗时间4天,32例治疗时间5天,而仅有8例治疗时间6天,1例治疗时间7天或更长时间。在接受安慰剂的患者中,270例使用时间4天,43例使用时间5天,而仅有3例使用时间6天,2例使用时间7天或更长时间。两组具有相似的人口统计学数据。帕瑞昔布和安慰剂的治疗时间平均值(标准差)分别为4.1(0.4 )天和4.2 (0.5)天,范围分别为4~7天和4~9天。接受帕瑞昔布治疗4~7天(中位时间4天)的患者,在治疗第3天后的不良事件发生率较低,与安慰剂组相似。
对阿片类药物用量的降低作用:在一项安慰剂对照、骨科及普外科手术的研究(n=1050)中,患者接受起始剂量40mg、随后20mg,一日两次,至少72h治疗,并接受包括患者自控阿片类药物作为辅助治疗的标准化处理。使用本品治疗的患者在第2天和第3天时阿片类药物用量分别减少了7.2mg和2.8mg(分别减少了37%和28%)。阿片类药物用量减少的同时,患者自发报告阿片类相关症状不适有了显著减少。和单独应用阿片类药物相比,联合应用帕瑞昔布可获得更多的疼痛缓解。其他手术模型的研究也可观察到类似的结果。当与阿片类药物联合应用时,没有数据显示应用帕瑞昔布组总体不良事件发生率低于安慰剂组。
有关胃肠道的临床研究:在为期7天的短期临床研究中,在使用本品的青年与老年(≥65岁)健康受试者中,内窥镜下胃及十二指肠溃疡和粘膜糜烂的发生率为5%~21%。发生率高于安慰剂组(5%~12%),然而显著低于NSAIDs组(66%~90%)。
冠状动脉搭桥术后安全性研究:除常规不良事件报告外,还进行了两次安慰剂对照的安全性研究,对由独立专家委员会预先指定事件类别进行分析。在研究过程中,受试者首先接受为期至少3天的帕瑞昔布治疗,然后口服伐地昔布,总治疗期为10-14天。所有受试者在治疗期间均接受标准止痛护理。受试者在随机分组前及两项研究过程中均服用低剂量阿司匹林。第一项冠状动脉搭桥手术研究是为期14天的双盲安慰剂对照研究。受试者首先静脉注射帕瑞昔布钠(40mg,一日两次)至少3天,随后接受伐地昔布(40mg,一日两次,帕瑞昔布钠/伐地昔布组,n=311)或安慰剂/安慰剂(n=151)。对9项预先指定的不良事件类别(包括心血管血栓栓塞事件、心包炎、充血性心力衰竭的发生或恶化、肾功能衰竭/功能损伤、上消化道溃疡、非胃肠道大出血、感染、非感染性肺部并发症及死亡)进行评估。静注给药期间和全部研究过程中,帕瑞昔布/伐地昔布组心血管/血栓栓塞事件(包括心肌梗死、心肌缺血、脑血管意外、深度静脉栓塞以及肺栓塞)的发生率均明显高于安慰剂/安慰剂治疗组(静注给药期间分别为2.2%和0.0%;全部研究期间分别为4.8%和1.3%)。帕瑞昔布/伐地昔布组手术伤口并发症(主要是胸骨伤口)发生率增高。第二项冠状动脉搭桥手术研究,对四类预先指定不良事件(包括心血管/血栓栓塞、肾功能异常/肾功能衰竭、上消化道溃疡/出血、手术伤口并发症)进行评估。病人在冠状动脉搭桥术后24小时内被随机分组:帕瑞昔布/伐地昔布组(帕瑞昔布静注起始剂量40mg,随后静注帕瑞昔布20mg,每日2次,至少3天,接着口服伐地昔布20mg ,每日2次,维持治疗10天)(n=544);安慰剂/伐地昔布组(静注安慰剂,随后口服伐地昔布)(n=544);或者安慰剂/安慰剂组(静注安慰剂,随后口服安慰剂)(n=548)。评估结果表明:帕瑞昔布/伐地昔布治疗组(2.0%)心血管/血管栓塞类事件的发生率明显高于安慰剂/安慰剂组 (0.5%) (P=0.033)。安慰剂/伐地昔布治疗组心血管血栓栓塞事件的发生率高于安慰剂/安慰剂组,但不具有显著统计学差异。安慰剂/伐地昔布治疗组共发生6例心血管血栓栓塞事件,其中3例发生在安慰剂治疗期间。这些患者没有接受伐地昔布治疗。在所有三组治疗组中,预先指定事件发生率最高的是手术伤口并发症,包括深部手术感染及胸骨伤口愈合事件。治疗组和安慰剂组在其它事件类别(肾功能异常/肾功能衰竭,上胃肠道溃疡并发症或手术伤口并发症)的发生率上没有显著性差异。
常规手术:大规模骨科/普外科手术研究中(n=1050),患者接受静注帕瑞昔布治疗,起始剂量为40mg,随后静注20mg,每日2次,至少3天,再口服伐地昔布20mg,每日2次,维持治疗10天(n=525),或者先静注安慰剂,随后口服安慰剂(n=525)。两组在所有安全性资料方面没有显著性差异,其中包括上述第二次冠状动脉搭桥术研究中的四项预先指定的事件类别。
有关血小板的临床研究:在一系列小型、多次给药的临床研究中,给予青年与老年健康受试者帕瑞昔布20mg或40mg,一天两次。与安慰剂组相比,帕瑞昔布对血小板聚集或出血没有影响。在青年受试者中,帕瑞昔布(一次40mg,一天两次)对阿司匹林介导的血小板功能抑制没有临床显著影响。
【药理毒理】药理作用 帕瑞昔布是伐地昔布的前体药物。伐地昔布在临床剂量范围是选择性COX-2抑制剂。
毒理研究
遗传毒性 帕瑞昔布Ames试验、CHO/HGPRT哺乳动物细胞基因突变试验、大鼠体内骨髓微核试验结果为阴性;CHO细胞染色体畸变试验中,帕瑞昔布在有或无S9(大鼠肝脏微粒体)条件下作用4小时结果为阳性,在无S9条件下作用24小时结果为阴性。
生殖毒性 妊娠兔给予帕瑞昔布,在不引起母体毒性的剂量时可见着床后丢失、吸收胎以及胎仔体重增长迟滞。帕瑞昔布对雄性或雌性大鼠生育力未见影响。尚未评价帕瑞昔布对妊娠晚期或围产期的影响。哺乳期大鼠单次静脉注射给予帕瑞昔布,乳汁中的帕瑞昔布、伐地昔布以及伐地昔布活性代谢物的浓度与母体血浆浓度相似。
致癌性 尚未评价帕瑞昔布的致癌性。
【药代动力学】帕瑞昔布在静注或肌注后经肝脏酶水解,迅速转化为有药理学活性的物质——伐地昔布。
吸收 本品单次给药后,在临床剂量范围内,以血药浓度-时间曲线下面积(AUC)以及峰浓度(Cmax)两项指标代表的伐地昔布的暴露水平近似线性表达。帕瑞昔布一天给药两次,静注剂量不超过50mg及肌注剂量不超过20mg的情况下,其AUC与Cmax之间呈现线性关系。帕瑞昔布一天给药两次,在4天内可达到伐地昔布的稳态血药浓度。帕瑞昔布单次静注或肌注20mg,伐地昔布分别于注射后约30分钟或1小时达到峰浓度。静脉给药或肌内注射给药,伐地昔布的暴露水平(AUC及Cmax)基本相同。静注或肌注后,帕瑞昔布的暴露水平基本相同(AUC);但肌注后的帕瑞昔布平均Cmax低于静注后的平均Cmax,这可能与肌注后药物在血管外吸收较慢有关。由于静注或肌注帕瑞昔布后伐地昔布的峰浓度基本一致,因此上述差别并无重要临床意义。
分布 静注后,伐地昔布的分布容积约为55升。血浆蛋白结合率在最高推荐剂量(80mg/天)时达到98%。伐地昔布
(而非帕瑞昔布)可广泛分布于红细胞内。
代谢 帕瑞昔布在体内快速并几乎完全地转化为伐地昔布和丙酸,血浆半衰期约为22分钟。伐地昔布的消除在肝脏内通过多种途径广泛进行,包括细胞色素P450(CYP)3A4与CYP2C9同工酶代谢以及磺胺葡萄糖醛酸化(约20%)。已在人体血浆中确认伐地昔布的一种羟化代谢物(经CYP途径代谢)也具有抑制COX-2作用,它的体内浓度相当于伐地昔布浓度的约10%。由于这种代谢物的浓度较低,因此给予治疗剂量帕瑞昔布后,并不期望这种代谢物发挥重要的临床作用。
消除 伐地昔布主要在肝脏内消除,少于5%的伐地昔布通过尿液以原型形式排泄。尿液中未检测到帕瑞昔布的原型物质,粪便中仅检测到痕量原型物质。给药后,约70%的药物以非活性代谢物形式经尿排泄。伐地昔布的血浆清除率(CLp)约为6L/小时。静注或肌注帕瑞昔布钠后,伐地昔布的消除半衰期(t1/2)约为8小时。
老年人:在药代动力学与临床治疗研究中,335例老年患者(65~96岁)接受本品治疗。在健康老年受试者中,由于伐地昔布口服表观清除率降低,导致伐地昔布血浆暴露水平较健康年轻受试者升高约40%。校正体重后,老年女性受试者的伐地昔布稳态血药浓度较老年男性高16%。
肾功能损伤:不同程度肾功能损伤的患者静注帕瑞昔布20mg后,帕瑞昔布均从血浆中快速清除。由于肾脏消除不是伐地昔布主要的消除途径,即使在严重肾功能损伤或依赖透析的患者中也未发现伐地昔布清除率的改变。
肝功能损伤:中度肝功能损伤并不引起帕瑞昔布-伐地昔布转换速率或转换程度的降低。对于中度肝功能损伤的患者(Child-Pugh 评分:7~9),由于伐地昔布的暴露水平可升高至正常范围的两倍以上(+130%),故帕瑞昔布的初始剂量应减至常规推荐量的二分之一,且每日最高剂量降至40mg。目前尚未对严重肝功能损伤患者的用药状况进行研究,因此不推荐这类患者使用帕瑞昔布。
【贮 藏】密闭保存。配制后的药液仅供单次使用,不得冷冻或冷藏。
【包 装】中硼硅玻璃管制注射剂瓶,冷冻干燥注射用无菌粉末用溴化丁基橡胶塞。
包装规格:1瓶/盒、2瓶/盒、5瓶/盒、10瓶/盒。
【有 效 期】12个月
【执行标准】YBH02872019
【批准文号】(1)20mg:国药准字H20193380 (2)40mg:国药准字H20193381
【生产企业】
企业名称:山东罗欣药业集团股份有限公司
生产地址:山东省临沂高新技术产业开发区罗七路
邮政编码:276017
电话号码:0539-8257899 8481991 传真号码:0539-8481990
售后服务:0539-8242699 网 址:www.luoxin.cn
【适应症】用于手术后疼痛的短期治疗。在决定使用选择性环氧化酶-2(COX-2)抑制剂前,应评估患者的整体风险。
【用法用量】推荐剂量为40mg静脉注射(IV)或肌内注射(IM)给药,随后视需要间隔6~12小时给予20mg或40mg,每天总剂量不超80mg。由于选择性COX-2抑制剂的心血管事件发生风险随着剂量及暴露时间增加而增加,因此,应尽可能使用最短疗程及最低每日有效剂量。使用本品超过三天的临床经验有限。可直接进行快速静脉推注,或通过已有静脉通路给药。肌内注射应选择深部肌肉缓慢推注。由于本品与其它药物在溶液中混合可出现沉淀,因此不论在溶解或是注射过程中,本品严禁与其它药物混合。如帕瑞昔布与其它药物使用同一条静脉通路,帕瑞昔布溶液注射前后须采用相容溶液充分冲洗静脉通路。
与阿片类镇痛药联合用药:阿片类镇痛药可以与帕瑞昔布同时应用,本品使用剂量参见上文。在所有的临床评估中,帕瑞昔布是固定间隔时间给药,而阿片类药物则是按需给药。
老年患者:通常,对于老年患者(≥65岁)不必进行剂量调整。但是,对于体重低于50kg的老年患者,本品的初始剂量应减至常规推荐剂量的一半且每日最高剂量应减至40mg。
肝功能损伤:目前尚无严重肝功能损伤患者(Child-Pugh 评分:≥10)的临床用药经验,因此禁止在此类患者中使用帕瑞昔布。通常,轻度肝功能损伤的患者(Child-Pugh 评分:5~6)不必进行剂量调整。中度肝功能损伤的患者(Child-Pugh 评分:7~9)应慎用本品,剂量应减至常规推荐剂量的一半且每日最高剂量降至40mg。
肾功能损伤:对于重度肾功能损伤(肌酐清除率:<30ml/min)或有液体潴留倾向的患者,应选择最低推荐剂量(20mg)开始治疗并密切监测肾功能。依据帕瑞昔布的药代动力学,不必对轻度至中度肾功能损伤(肌酐清除率:30~80ml/min)的患者进行剂量调整。
儿童用药:尚未确定18岁以下儿童使用帕瑞昔布的安全和疗效。目前尚无可用数据。因此,不推荐在此类人群中使用帕瑞昔布。
使用与处置(包括丢弃)指导说明 注射用帕瑞昔布钠使用前必须重新配制。由于不含防腐剂。因此要求采用无菌技术进行配制。
配制溶剂:可用于配制注射用帕瑞昔布钠的溶剂包括:氯化钠溶液9mg/ml(0.9%);葡萄糖注射液50mg/ml(5%);氯化钠4.5mg/ml(0.45%)葡萄糖50mg/ml(5%)注射液。
配制过程 采用无菌技术配制帕瑞昔布冻干粉(即帕瑞昔布)。去除启扣盖,暴露帕瑞昔布玻璃瓶橡胶瓶塞的中央部分。用无菌注射器及针头吸取适用溶剂(20mg帕瑞昔布钠用1ml溶剂配制,40mg帕瑞昔布钠用2ml溶剂配制),然后将针头插进橡胶瓶塞中央向瓶内注入溶剂。轻轻旋转瓶体使粉末完全溶解并在使用前仔细检查配制成的溶液。将瓶内全部药液抽出供单次给药。配制后,药液应为透明溶液。帕瑞昔布钠溶液应在使用前进行目测,确定溶液是否有不溶性微粒或发生变色。若观察到溶液发生变色,出现絮状物或不溶性微粒,则不得使用。配置后,帕瑞昔布钠溶液应在24小时内使用,否则应废弃。已经证实在25℃条件下,配制后药液(不得冷藏或冷冻)的物理、化学稳定性最长可保持24小时。因此,24小时应被视为药物配制后的最长有效期。然而,由于注射产品有微生物感染的重要风险,因此配制的溶液应立即使用,除非溶液的配制是在严格控制的、并经过验证的无菌环境中进行。除非满足上述条件,否则使用者必须在使用前控制其贮藏时间与条件。一般来说,在25℃条件下保存不应超过12小时。配制后的帕瑞昔布钠溶液为等渗溶液。
静脉通路溶液的相容性 采用适用溶液配制后,帕瑞昔布钠溶液只能以静脉注射、肌肉注射、或加入下列液体的静脉通路给药:氯化钠注射液9mg/ml(0.9%) 葡萄糖注射液50mg/ml(5%) 氯化钠4.5mg/ml(0.45%)和葡萄糖50mg/ml(5%) 注射液 乳酸林格氏液 由于可以导致帕瑞昔布在溶液中沉淀,故不推荐向含50mg/ml(5%)葡萄糖的乳酸林格氏液或其它未列出溶液的静脉通路中加入帕瑞昔布。配制后的药液仅供单次使用。任何配制后未使用的医药产品或废弃物品都应当按照当地要求予以处理。
药物的不相容性 除[使用与处置(包括丢弃)指导说明]所列药物外,帕瑞昔布不得与其它任何药物混合。本品不应与阿片类药物混和于同一注射器内给药。使用乳酸林格氏液或含50mg/ml(5%)葡萄糖的乳酸林格氏液配制,帕瑞昔布会在溶液中发生沉淀,故不推荐使用。不推荐使用注射用水,因为得到的溶液不等渗。帕瑞昔布钠溶液不应注入任何其它药物的静脉通路。帕瑞昔布钠溶液注射前后应用相容溶液充分冲洗静脉通路。由于可以导致帕瑞昔布在溶液中沉淀,故不推荐向含50mg/ml(5%)葡萄糖的乳酸林格氏液或其他[使用与处置(包括丢弃)的指导]中未列出溶液的静脉通路中加入帕瑞昔布。